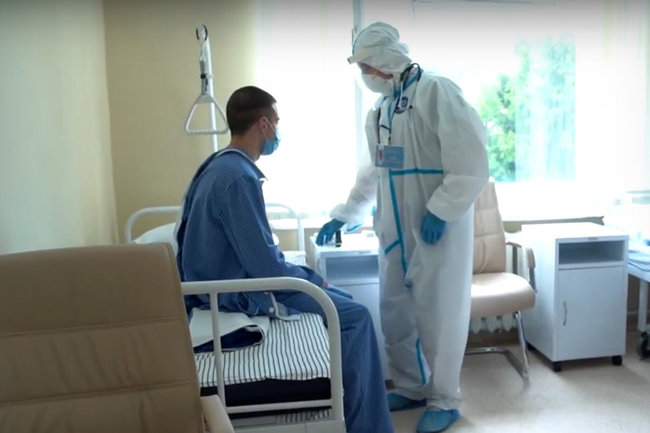
В Минобороны РФ поспешили с выводами о качестве разработанной вакцины на основании того, что в первых двух группах добровольцев все чувствуют себя хорошо.
Вторую группу участников испытаний выписали 20 июня, а уже на следующий день в оборонном ведомстве объявили о готовности препарата. «На момент выписки все без исключения добровольцы, получив иммунитет к коронавирусу, чувствовали себя нормально. Таким образом, первая отечественная вакцина от новой коронавирусной инфекции готова», — сказал первый заместитель министра обороны России Руслан Цаликов в интервью «Аргументам и фактам».
Как напоминает Накануне.RU, после первых испытаний вакцины у всех добровольцев выявили необходимые антитела, на чем, по всей видимости, в Минобороны посчитали достаточным сделать общий вывод о вакцине.
В этот же день глава Российского фонда прямых инвестиций (РФПИ) Кирилл Дмитриев сообщил, что к концу года Россия может создать более 200 млн доз препарата. Часть партии планируется использовать за рубежом. «30 млн доз будет произведено в России, а остальное — с помощью международных партнерств по всему миру», — заявил Дмитриев в беседе с журналистами портала «Стопкоронавирус.рф».
Тем временем министр здравоохранения Михаил Мурашко и директор Центра им. Гамалеи, где разрабатывается вакцина, Александр Гинцбург полагают, что к середине августа российская вакцина получит государственную регистрацию. Гинцбург также уверен, что к 14-15 августа вакцина уже начнет поступать в больницы.
Три этапа клинических исследований
Издание РБК пишет, что наблюдением за двумя группами добровольцев завершился только первый этап клинических испытаний. Вторая фаза должна завершиться 3 августа. А третья фаза «пройдёт в ОАЭ, Турции и других странах».
(function(w, d, n, s, t) {
w[n] = w[n] || [];
w[n].push(function() {
Ya.Context.AdvManager.render({
blockId: «R-A-48398-30»,
renderTo: «yandex_rtb_R-A-48398-30»,
async: true
});
});
t = d.getElementsByTagName(«script»)[0];
s = d.createElement(«script»);
s.type = «text/javascript»;
s.src = «//an.yandex.ru/system/context.js»;
s.async = true;
t.parentNode.insertBefore(s, t);
})(this, this.document, «yandexContextAsyncCallbacks»);
Подробнее о трех этапах испытаний ранее в интервью Forbes рассказала иммунолог Полина Делетич. По ее словам, 1-я фаза проводится в малых группах волонтеров (20-100 человек). Как правило, она занимает 3 месяца. «На этом этапе главный вопрос — это безопасность применения вакцины для человека и наличие серьезных побочных эффектов», — обратила внимание Делетич.
На втором этапе препарат вводят сотням человек, проверяя оптимальную дозировку и иммунную реакцию. На третьем – вакцину вводят уже тысячам человек. Причем одним – настоящий препарат, а другим – плацебо.
Делетич резюмировала, что в среднем клинические испытания занимают 2-4 года, но при необходимости процесс можно ужать до 12-18 месяцев. Это возможно в том случае, если новая вакцина разрабатывается на базе уже существующей. Продолжительность клинических испытаний можно сократить, когда во второй фазе участвует достаточно большое количество добровольцев, а вакцина показала эффективность и отсутствие побочных эффектов. «Комиссия может одобрить начало масштабного производства препарата одновременно с началом третьей фазы исследований», — пояснила Полина Делетич.
Глава научно-исследовательского центра по профилактике и лечению вирусных инфекций Георгий Викулов тоже придерживается мнения, что три этапа клинических испытаний должны занимать минимум около полугода.
В эфире радиостанции «Комсомольская правда» он указал, что по завершении всех испытаний, за участниками эксперимента нужно понаблюдать еще 12 месяцев. «Нормальное исследование вакцины суммарно занимает примерно полтора», — констатировал Викулов.
Вирусолог Национального исследовательского центра имени Гамалеи Виктор Зуев в интервью телеканалу «Дождь» по поводу заявлений о «завершении» клинических испытаний особо отметил, что они еще «не завершены».
«Это, кажется, начало пути. Его остаток, правда, обещают преодолеть в рекордные сроки и осенью начать масштабное производство препарата. Хотя его, по идее, должны исследовать на гораздо большем количестве добровольцев, чем сейчас», — заметил Зуев.
На спешку с вакциной пожаловался также генеральный партнер и сооснователь биотехфонда ATEM Capital Антон Гопка. Он согласился, что если вакцина делается только для потребления внутри страны, то выборка добровольцев может быть меньше. Тем не менее, это в любом случае тысячи человек, ведь вакцину собираются вводить десяткам миллионов. «Сделать до конца сентября вторую-третью фазу, конечно, это малореалистично», — подытожил Антон Гопка.
Минздрав одернул Минобороны за спешку
Помощник министра здравоохранения Алексей Кузнецов утром 21 июня в интервью РБК прокомментировал выводы Минобороны о готовности вакцины, напомнив, что вторая фаза клинических испытаний еще продолжается, хотя и находится на завершающем этапе. Он пояснил, что в этом свете рассуждать о готовности препарата преждевременно, добавив, что «вопрос о госрегистрации будет решаться по окончании (второй фазы)».