Исследования смертельно опасных вирусов часто кажутся людям излишне рискованными и служат источником для возникновения конспирологических теорий. В этом смысле не стала исключением и начавшаяся пандемия COVID‑2019 — в Сети то и дело возникают панические слухи о том, что вызвавший её коронавирус был выращен искусственно и то ли специально, то ли по недосмотру выпущен в свет. В нашем материале мы разбираем, зачем люди продолжают работать с опасными вирусами, как это происходит и почему вирус SARS‑CoV‑2 совсем не похож на беглеца из лаборатории.
Человеческое сознание не может принять бедствие как случайность. Что бы ни произошло — засуха, лесной пожар, даже падение метеорита, — нам необходимо найти какую‑то причину произошедшего, нечто, что поможет дать ответ на вопрос: почему это случилось сейчас, почему это случилось с нами и что надо сделать, чтобы это не произошло вновь?
Эпидемии здесь не исключение, скорее, даже правило — не счесть конспирологических теорий вокруг ВИЧ, архивы фольклористов ломятся от историй о заражённых иглах, оставленных в сиденьях кинотеатров, об инфицированных пирожках.
«Биологический Чернобыль»
Нынешняя эпидемия, вошедшая буквально в каждый дом, тоже требует рационального — то есть магического — объяснения. Множеству людей требовалось найти понятную и, желательно, устранимую причину, и она нашлась почти сразу: этот «биологический Чернобыль» спровоцировали учёные и их безответственные эксперименты с вирусами.
Надо сказать, что однажды «биологический Чернобыль» действительно произошёл, правда, он не был похож на нынешнюю пандемию коронавируса. Это случилось в самом начале апреля 1979 года в Свердловске (сегодняшнем Екатеринбурге), где люди внезапно начали скоротечно умирать от неизвестной болезни.
Болезнь оказалась сибирской язвой, а её источником стал завод по производству бактериологического оружия, где по одной из версий, забыли вернуть на место защитный фильтр. Всего погибло 68 человек, причём 66 из них, как выяснили авторы исследования, опубликованного The Sverdlovsk anthrax outbreak of 1979 в журнале Science в 1994 году, жили точно в направлении выброса с территории военного городка 19.
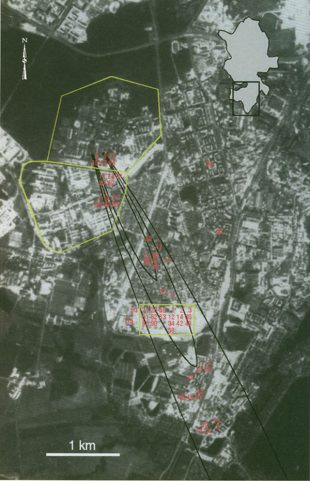
Этот факт, а также необычная для сибирской язвы форма болезни — лёгочная — практически не оставляют места для официальной версии, гласившей, что эпидемия была связана с заражённым мясом.
«Пострадавший город столкнулся не с каким‑то гибридом чумы, не с микстом, а с сибирской язвой особого штамма — палочкой с перфорированной оболочкой из другого, стрептомициноустойчивого штамма Б 29», — писал Смерть из пробирки. Что случилось в Свердловске в апреле 1979 года? один из исследователей истории этой аварии Сергей Парфёнов.
Жертвы этой аварии погибли от специально наработанных «военных» патогенов, предназначенных для быстрого и массового убийства людей.
Можно ли сказать, что сейчас происходит нечто подобное, но в глобальном масштабе? Могли ли учёные создать новый, более опасный искусственный вирус? Если да, то как и зачем они это сделали? Можем ли мы определить происхождение нового коронавируса? Можем ли мы считать, что тысячи людей погибли из‑за ошибки или преступления биологов? Попробуем разобраться.
Птицы, хорьки и мораторий
В 2011 году две исследовательские группы под руководством Рона Фуше и Йошихиро Каваока заявили, что им удалось модифицировать вирус птичьего гриппа H5N1. Если исходный штамм может передаваться к млекопитающему только от птицы, то модифицированный мог передаваться и среди млекопитающих, а именно хорьков. Эти животные были выбраны в качестве модельных организмов потому, что их реакция на вирус гриппа наиболее близка человеческой.
Статьи с результатами исследования и описанием методов работы были отправлены в журналы Science и Nature — но не были опубликованы. Публикация была остановлена по требованию Национальной научной комиссии по биобезопасности США, посчитавшей, что технология модификации вируса может попасть в руки террористов.
Идея облегчить опасному вирусу, от которого умирает 60 процентов заболевших птиц, распространение среди млекопитающих вызвала бурные обсуждения Benefits and Risks of Influenza Research: Lessons Learned и в научном сообществе.
Дело в том, что вирусу, научившемуся распространяться в хорьках, гораздо проще научиться распространяться в людях в случае «побега» из лаборатории.
Итогом дискуссии стал добровольный 60‑месячный мораторий на исследования по этой тематике, отменённый в 2013 году после принятия новых регулирующих норм.
Работы Фуше и Каваоки в конце концов были опубликованы Airborne Transmission of Influenza A/H5N1 Virus Between Ferrets (правда, из статей убрали некоторые ключевые детали), и они наглядно продемонстрировали, что для перехода к распространению между млекопитающими вирусу надо очень мало и риск появления такого штамма в природе велик.
В 2014 году, после нескольких инцидентов в американских лабораториях, министерство здравоохранения США полностью остановило проекты, связанные с исследованиями трёх опасных патогенов: вируса гриппа H5N1, MERS и SARS. Тем не менее в 2019 году учёным удалось договориться EXCLUSIVE: Controversial experiments that could make bird flu more risky poised to resume о том, что часть работ по изучению птичьего гриппа будет всё-таки продолжена с усиленными мерами безопасности.
Такие предосторожности не безосновательны — известны случаи, когда вирусы «сбегали» из гражданских лабораторий. Так, спустя несколько месяцев после окончания эпидемии SARS‑CoV в 2003 году пневмонией заболели SARS Update—May 19, 2004 два студента Национального Института вирусологии в Пекине и ещё семь связанных с ними человек. Лабораторию института, занимавшуюся исследованиями SARS, немедленно закрыли, а всех пострадавших изолировали, так что заболевание не распространилось дальше.
Катастрофа в пробирке
Зачем обычные гражданские учёные, не военные и не террористы, рискуют жизнью миллионов человек, создавая потенциально опасные штаммы вирусов? Почему нельзя ограничиться исследованием уже существующих вирусов, тоже доставляющих немало проблем?
Если коротко, учёные хотят овладеть методом предсказания, как именно может произойти катастрофа, и заранее найти способ её остановить или хотя бы снизить ущерб.
Появление смертельно опасного и легко распространяющегося вируса с неизученным поведением представляет угрозу для людей. Если учёные и медики понимают, как именно происходит трансформация потенциального патогена и заранее знают его основные свойства, противостоять новой напасти — или предотвратить её — становится значительно легче.
Многие крупные эпидемии последних лет были связаны с тем, что вирус, распространённый среди животных, в результате эволюции приобретал способность заражать людей и передаваться от человека к человеку.
Предыдущие эпидемии птичьего гриппа и синдромов SARS и MERS были спровоцированы контактами людей с животными — хозяевами вирусов: птицами, циветами, одногорбыми верблюдами. Несмотря на то, что эпидемии удавалось остановить и вирус исчезал из популяции людей, он всегда оставался в природном резервуаре и в любой момент мог снова «перепрыгнуть» на человека.
Учёные продемонстрировали Transmission and evolution of the Middle East respiratory syndrome coronavirus in Saudi Arabia: a descriptive genomic study , что вирус, провоцирующий MERS, «перепрыгивал» со своего основного хозяина — одногорбого верблюда — на человека не один раз, так что каждая вспышка заболевания была связана с отдельным переходом и спровоцирована независимыми мутациями вируса.
После эпидемии атипичной пневмонии 2003 года, вызванной вирусом SARS‑CoV, вышло много статей (например, раз, два и три), основной посыл которых сводился к тому, что в природе существует постоянный «резервуар» вирусов, похожих на SARS‑CoV. Их хозяева, в основном, — летучие мыши, и вероятность «перепрыгивания» вируса с них на людей высока, так что стоит быть готовым к новой эпидемии, говорилось Severe Acute Respiratory Syndrome Coronavirus as an Agent of Emerging and Reemerging Infection в обзоре, опубликованном ещё в 2007 году.
В этом переходе большую роль играют промежуточные хозяева, в которых вирус может пройти необходимую адаптацию. В случае эпидемии 2003 года эту роль сыграли циветы. Сперва вирус летучих мышей жил в них, не вызывая симптомов, и только потом — пройдя адаптацию — перескочил к людям.
Это был не единственный потенциально опасный штамм: в 2007 году в окрестностях того же Уханя исследователи обнаружили Natural Mutations in the Receptor Binding Domain of Spike Glycoprotein Determine the Reactivity of Cross‑Neutralization between Palm Civet Coronavirus and Severe Acute Respiratory Syndrome Coronavirus цивет — носителей сестринского для штамма SARS‑CoV вируса, который на проверку очень плохо, но мог связываться с рецепторами человеческих клеток.
В 2013 году у летучих мышей — подковоносов был обнаружен Isolation and characterization of a bat SARS‑like coronavirus that uses the ACE2 receptor коронавирус, способный использовать для попадания в клетки не только их собственные рецепторы ACE2, но и рецепторы цивет и людей. Это поставило под сомнение необходимость промежуточного хозяина.
Позже, в 2018 году, исследователи из Института Вирусологии Уханя показали Serological Evidence of Bat SARS‑Related Coronavirus Infection in Humans, China , что иммунная система некоторых людей, проживающих неподалеку от пещер, где обитают летучие мыши, уже знакома с SARS‑подобными вирусами. Процент таких людей оказался невелик, но это ясно указывает: вирусы регулярно «проверяют» возможность заселиться в человека, и иногда им это удаётся.
Чтобы спрогнозировать угрозу, исходящую от потенциального патогена, требуется понимать, как именно он может измениться и каких изменений ему достаточно для того, чтобы стать опасным. Часто для этого недостаточно математических моделей или исследований уже прошедшей эпидемии, необходимы эксперименты.
Коронавирус‑химера
Именно для того, чтобы понять, насколько опасны циркулирующие в популяции летучих мышей вирусы, в 2015 году при участии той же лаборатории в Ухане был изготовлен A SARS‑like cluster of circulating bat coronaviruses shows potential for human emergence вирус‑химера, собранный из частей двух вирусов: лабораторного аналога SARS‑CoV и вируса SL‑SHC014, распространённого в подковоносах.
Вирус SARS‑CoV тоже пришёл к нам от летучих мышей, но с промежуточной «пересадкой» в цивете. Исследователи хотели узнать, насколько пересадка была необходима, и определить патогенный потенциал родственников SARS‑CoV, живущих в летучих мышах.
Важнейшую роль в том, сможет ли вирус заражать того или иного хозяина, играет S‑белок, получивший своё название от английского слова spike («шип»). Этот белок — главный инструмент вирусной агрессии, он цепляется за рецепторы ACE2 на поверхности клеток хозяина и обеспечивает проникновение в клетку.
Последовательности этих белков у разных коронавирусов довольно разнообразны и «подогнаны» в ходе эволюции под контакт с рецепторами своего конкретного хозяина.
Так, последовательности S‑белков у SARS‑CoV и SL‑SHC014 отличаются в ключевых местах, поэтому исследователи хотели разобраться, мешает ли это вирусу SL‑SHC014 перекинуться на человека. Учёные взяли S‑белок SL‑SHC014 и встроили его в модельный вирус, на котором изучают SARS‑CoV в лаборатории.
Выяснилось, что новый синтетический вирус не уступает исходному. Он мог заражать лабораторных мышей, а заодно проникать в клетки человеческих клеточных линий.
Это значит, что вирусы, обитающие в летучих мышах, уже несут в себе «детали», которые могут помочь им перекинуться на человека.
Дополнительно исследователи проверили, может ли вакцинация лабораторных мышей при помощи SARS‑CoV уберечь их от гибридного вируса. Оказалось, что нет, так что даже люди, переболевшие SARS‑CoV, могут оказаться беззащитны перед потенциальной эпидемией и старые вакцины не помогут.
Поэтому в своих выводах авторы статьи подчеркнули необходимость разработки новых лекарств, а позже приняли Broad‑spectrum antiviral GS‑5734 inhibits both epidemic and zoonotic coronaviruses в этом непосредственное участие.
Аналогичный этому обратный эксперимент — пересадка участка S‑белка SARS‑CoV вирусу летучих мышей Bat‑SCoV — была проведена Synthetic recombinant bat SARS‑like coronavirus is infectious in cultured cells and in mice ещё раньше, в 2008 году. В этом случае синтетические вирусы также оказались способны размножаться в линиях клеток человека.
Вот и он?
Если учёные могут создавать новые вирусы, в том числе потенциально опасные для человека, более того, если они уже экспериментировали с коронавирусом и создавали новые штаммы, то не значит ли это, что штамм, вызвавший нынешнюю пандемию, тоже был изготовлен искусственно?
Мог ли SARS‑CoV‑2 просто «сбежать» из лаборатории? Известно, что такой «побег» привёл к небольшой вспышке China’s latest SARS outbreak has been contained, but biosafety concerns remain – Update 7 SARS в 2003 году, уже после завершения «основной» эпидемии. Чтобы ответить на этот вопрос, необходимо разобраться в деталях технологии и понять, как именно делают модифицированные вирусы.
Основной метод — это сборка одного вируса из частей нескольких других. Этим способом как раз воспользовалась группа Ральфа Барика (Ralph Baric) и Ши Чжэнли (ZhengLi‑Li Shi), создавшая описанную выше химеру из «деталек» вирусов SARS‑CoV и SL‑SHC01.
Если секвенировать геном такого вируса, то можно увидеть блоки, из которых он был построен, — они будут похожи на участки исходных вирусов.
Второй вариант — воспроизводить эволюцию в пробирке. Этим путём шли исследователи птичьего гриппа, отбиравшие вирусы, более приспособленные к размножению в хорьках. Несмотря на то, что такой вариант получения новых вирусов возможен, конечный штамм останется близок к исходному.
Вызвавший сегодняшнюю пандемию штамм не подходит ни под один из перечисленных вариантов. Во‑первых, геном SARS‑CoV‑2 не обладает такой блочной структурой: отличия от других известных штаммов рассыпаны по всему геному. Это один из признаков естественной эволюции.
Во‑вторых, никаких вставок, похожих на другие патогенные вирусы, в этом геноме тоже не найдены.
Хотя в феврале был опубликован препринт, авторы которого якобы нашли в геноме вируса вставки ВИЧ, при ближайшем рассмотрении выяснилось HIV‑1 did not contribute to the 2019‑nCoV genome , что анализ был проведён некорректно: эти участки настолько малы и не специфичны, что с тем же успехом могут принадлежать огромному числу организмов. Кроме того, эти участки можно найти и в геномах «диких» коронавирусов летучих мышей. В итоге препринт был отозван.
Если сравнить геном коронавируса‑химеры, синтезированного в 2015 году, или двух исходных для него вирусов с геномом пандемического штамма SARS‑CoV‑2, то окажется, что они отличаются больше, чем на пять тысяч букв‑нуклеотидов, — это примерно одна шестая от общей длины генома вируса, и это очень большое расхождение.
Поэтому оснований считать, что современный SARS‑CoV‑2 — это версия синтетического вируса 2015 года, нет.

Дикие родственники
Сравнение геномов коронавирусов показало, что самый близкий известный родственник SARS‑CoV‑2 — это коронавирус RaTG13, найденный у летучей мыши — подковоноса Rhinolophus affinis из провинции Юннань в 2013 году. У них совпадают 96 процентов генома.
Это больше чем у остальных, но, тем не менее, нельзя назвать RaTG13 очень близким родственником SARS‑CoV‑2 и утверждать, что один штамм превратили в другой в лаборатории.
Если сравнить SARS‑CoV, вызвавший эпидемию 2003 года, и его непосредственного предка — вирус из циветы, — то окажется, что их геномы отличаются всего на 202 нуклеотида (0,02 процента). Разница между «диким» и полученным в лаборатории штаммом вируса гриппа меньше десятка мутаций.
На этом фоне дистанция между SARS‑CoV‑2 и RaTG13 огромная — более 1 100 рассыпанных по всему геному мутаций (3,8 процента).
Можно предположить, что вирус очень долго эволюционировал внутри лаборатории и приобрёл столько мутаций за много лет. В этом случае действительно будет невозможно отличить лабораторный вирус от дикого, поскольку они развивались по одним и тем же законам.
Но вероятность появления такого вируса крайне мала.
При хранении вирусы стараются держать в покое — именно для того, чтобы они сохранялись в первозданном виде, а результаты экспериментов над ними фиксируются в регулярно появляющихся публикациях Уханьской лаборатории Ши Чжэнли.
Гораздо больше шансов найти прямого предка этого вируса не в лаборатории, а среди коронавирусов летучих мышей и потенциальных промежуточных хозяев. Как уже упоминалось, в районе Уханя уже обнаруживались циветы — носители потенциально опасных вирусов, есть и другие возможные переносчики. Их вирусы разнообразны, но скудно представлены в базах данных.
Узнав о них больше, мы, скорее всего, сможем лучше понять, как вирус попал к нам. Судя по генеалогическому дереву геномов, все известные SARS‑CoV‑2 — это потомки одного вируса, жившего примерно в ноябре 2019 года. Но где именно жили его близкие предки до первых случаев COVID‑19, мы не знаем.
Два особых участка
Несмотря на то, что отличия от других известных коронавирусов рассыпаны по всему геному SARS‑CoV‑2, исследователи пришли к выводу, что ключевые для заражения человека мутации сконцентрированы в двух участках гена, кодирующего S‑белок. Эти два участка тоже имеют природное происхождение.
Первый из них отвечает за правильное связывание с рецептором ACE2. Из шести ключевых аминокислот на этом участке у родственных вирусных штаммов совпадает не больше половины, а у самого близкого родственника RaTG13 — только одна. Патогенность для человека штамма с таким сочетанием описана впервые, а идентичное сочетание нашлось пока только в последовательности коронавируса панголина.
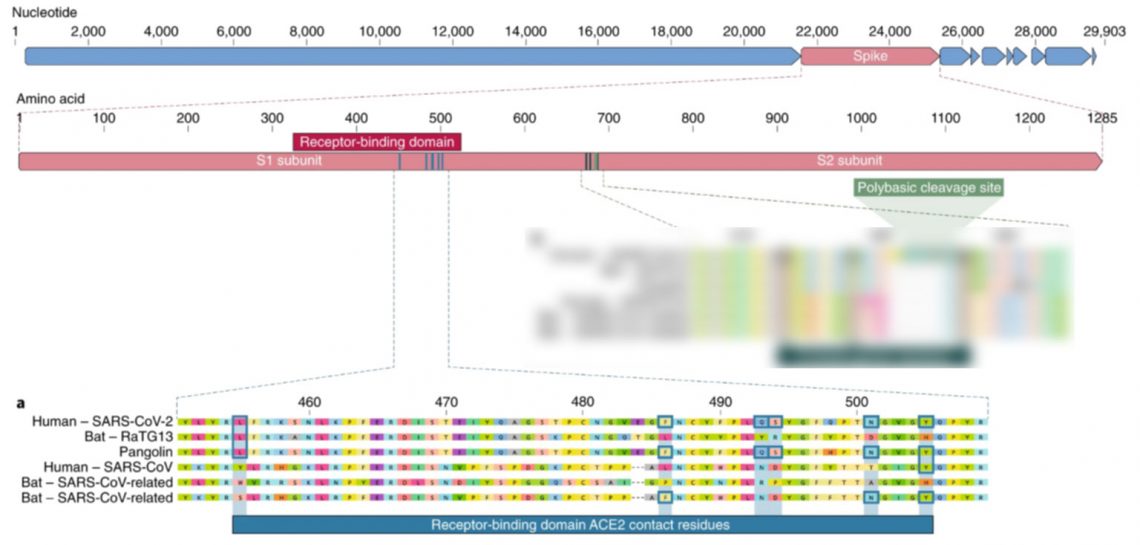
Из того, что эти ключевые аминокислоты одинаковы у вируса панголина и человека, нельзя сделать однозначный вывод о том, что этот участок имеет общее происхождение. Это может быть примером параллельной эволюции, когда вирусы или другие организмы независимо друг от друга приобретают сходные черты.
Самый известный пример такого процесса — когда бактерии независимо друг от друга получают устойчивость к одному и тому же антибиотику. Аналогично и вирус, приспосабливаясь к жизни в организмах с похожими рецепторами ACE2, может эволюционировать сходным образом.
Альтернативный сценарий для получения такой картины, наоборот, предполагает Pangolin homology associated with 2019‑nCoV , что все шесть ключевых аминокислот присутствовали у общего предка вируса панголина, RaTG13 и SARS‑CoV‑2, но позже были заменены у RaTG13 на другие.
Помимо клеток человека, S‑белок SARS‑CoV‑2, возможно, способен Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade‑Long Structural Studies of SARS Coronavirus узнавать рецепторы ACE2 других животных, например хорьков, кошек или некоторых обезьян, из‑за того что молекулы этих рецепторов идентичны или очень похожи на человеческие в местах их взаимодействия с вирусом. Это значит, что круг хозяев вируса не обязательно ограничен человеком и он мог долгое время «тренировать» взаимодействие с похожими рецепторами, живя в другом животном. (Это теоретическое предположение, основанное на расчётах, — никаких доказательств того, что вирус мог бы передаваться через домашних животных вроде кошек и собак, нет).
Могли ли эти аминокислоты были вставлены искусственно?
Из предыдущих исследований известно, что S‑белок очень вариативен. Этот вариант шести аминокислот — не единственный из способных научить вирус цепляться к клеткам человека и, более того, как показано Receptor Recognition by the Novel Coronavirus from Wuhan: an Analysis Based on Decade‑Long Structural Studies of SARS Coronavirus в одной из свежих работ, не идеален с точки зрения «вредности» вируса.
Как было описано выше, последовательности S‑белков, способных связываться с рецепторами ACE2, известны давно, и искусственное «улучшение» вируса при помощи именно этой неизвестной ранее последовательности аминокислот — к тому же не оптимальной — кажется маловероятным.
Вторая особенность S‑белка SARS‑CoV‑2 (помимо тех шести аминокислот) — это способ его разрезания. Чтобы вирус попал в клетку, S‑белок должен быть разрезан в определённом месте ферментами клетки. У всех остальных родственников, включая вирусы летучих мышей, панголинов и людей, место разреза представляет собой всего одну аминокислоту, тогда как у SARS‑CoV‑2 — сразу четыре.
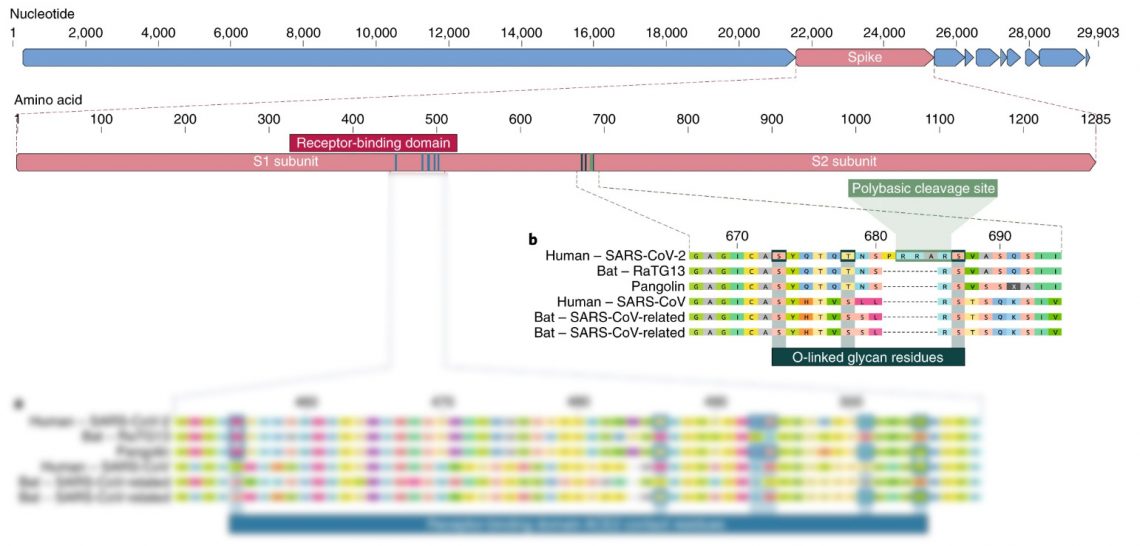
Как эта добавка повлияла на его способность распространяться среди людей и других видов, пока не ясно. Известно, что аналогичное природное перерождение места разреза у птичьего гриппа существенно расширило The proximal origin of SARS‑CoV‑2 круг его хозяев. Тем не менее исследований, которые бы подтвердили, что это справедливо для SARS‑CoV‑2, пока нет.
Таким образом, оснований считать, что вирус SARS‑CoV‑2 имеет искусственное происхождение, нет. Нам неизвестны его достаточно близкие и при этом хорошо изученные родственники, которые могли бы послужить основой для синтеза, никаких вставок в его геном из ранее изученных патогенов учёные также не обнаружили. Вместе с тем его геном организован в манере, соответствующей нашим представлениям о естественной эволюции этих вирусов.
Можно придумать громоздкую систему условий, при которых этот вирус всё-таки мог бы сбежать от учёных, но предпосылки для этого минимальны. В то же время шансы появления нового опасного штамма коронавируса из природных источников в научной литературе последнего десятилетия регулярно оценивались как очень высокие. И вызвавший пандемию SARS‑CoV‑2 в точности отвечает этим прогнозам.