Первый российский препарат от коронавирусный болезни «Авифавир» получил одобрение Минздрава. Разработчик препарата обещает, что уже 11 июня отправит первые партии своего лекарства в больницы. Разбираемся, откуда взялись эти жёлтые таблетки, по какому принципу работает препарат, какие клинические испытания он уже успел пройти и можно ли с определённостью сказать, что у нас появилось лекарство от COVID-19.
Откуда оно взялось
«Авифавир» — торговое наименование российского препарата, который разработали Российский фонд прямых инвестиций (РФПИ) и группа компаний «ХимРар». Однако действующее вещество препарата было изобретено не в России.
Его международное непатентованное наименование — фавипиравир (favipiravir). Разработали его сотрудники японской компании Toyama Chemical Toyama Chemical Co Ltd — дочерней компании корпорации FUJIFILM Pharmaceuticals.
По своей химической структуре фавипиравир — производное Favipiravir 6-фтор-3-оксо-3,4-дигидропиразин-2-карбоновой кислоты, или пиразинкарбоксамида. Во время скрининга химической библиотеки сотрудники компании Toyama обнаружили, что это вещество может обладать активностью против вируса гриппа: попав в заражённые вирусом клетки, фавипиравир превращается в активированную форму, подавляющую активность важного вирусного фермента РНК-зависимой РНК-полимеразы Coronavirus disease 2019 (COVID-19): Management in hospitalized adults .
Если «выключить» РНК-полимеразу, вирусы гриппа утрачивают способность «печатать» в заражённых клетках свой генетический материал, РНК. В результате производство вируса, уже проникшего в клетки, останавливается. В этом состоит уникальность препарата — обычно противовирусные лекарства могут только препятствовать проникновению вирусов в клетки.
РНК-зависимая РНК-полимераза есть не только в вирусах гриппа, но и во всех РНК-вирусах. Причём каталитический домен РНК-полимеразы — так называется участок молекулы, благодаря которому фермент в принципе может работать, — во всех РНК-вирусах устроен одинаково. А поскольку фавипиравир связывается именно с каталитическим доменом РНК-полимеразы, у японцев были основания считать это вещество противовирусным агентом широкого Favipiravir (T-705), a broad spectrum inhibitor of viral RNA polymerase спектра действия.
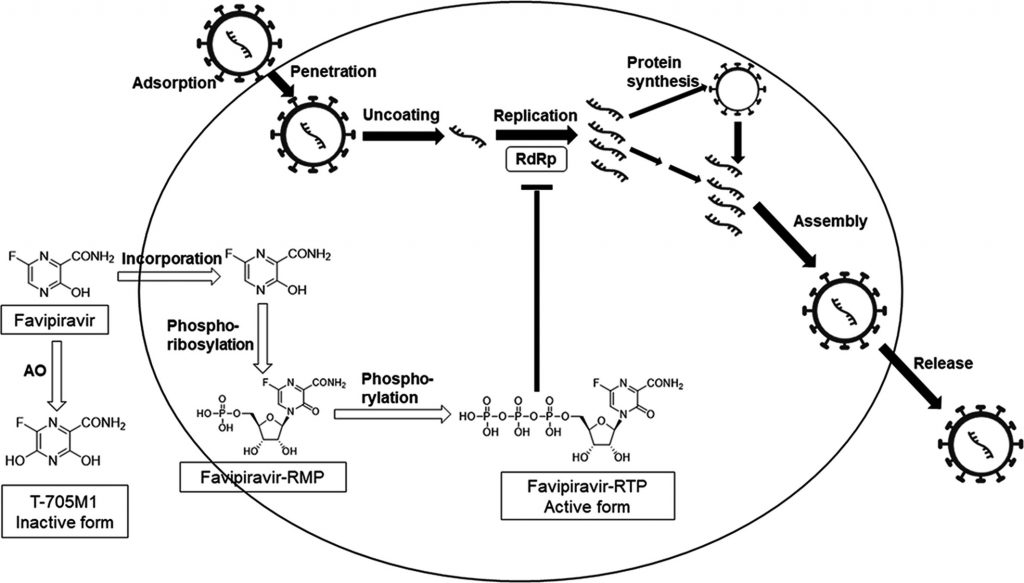
Сотрудники Toyama зарегистрировали фавипиравир под торговым названием Avigan и принялись исследовать активность многообещающего лекарства на РНК-вирусах Favipiravir (T-705), a Novel Viral RNA Polymerase Inhibitor : от вирусов гриппа типа A и B до вируса Эбола. Результаты были неоднозначными. Например, в случае вируса Эбола выяснилось, что на макаках препарат работал Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques , но во время применения на людях результат Survival times improved in favipiravir-treated Ebola patients был не очень впечатляющим. С одной стороны, уровень летальности у 73 пациентов из Гвинеи, получавших фавипиравир, был ниже, чем у пациентов, которых пытались лечить другими способами. С другой стороны, разница была не столь велика: 42,5 процента против 57,8 процента — то есть невозможно гарантировать, что это не просто случайный артефакт подсчёта, связанный с тем, что выборка пациентов была очень небольшой. Тем не менее правительство Гвинеи утвердило Japan sending Fujifilm’s flu drug favipiravir to over 40 countries for Covid-19 trials этот препарат в качестве стандартного лечения против вируса Эбола.
На родине препарата, в Японии, Avigan удалось зарегистрировать только в 2014 году — и только против новых штаммов вируса гриппа. Против сезонного гриппа Avigan не использовался.

Причём препарат был одобрен не просто против «нового» гриппа, а исключительно для ситуаций, когда существующие противовирусные средства оказались неэффективными — то есть в качестве крайнего средства. За шесть лет с момента одобрения такая ситуация не возникла ни разу, так что в условиях реальной эпидемии гриппа препарат ни разу не применяли.
Обзор 29 клинических исследований (4 299 участников), шесть из которых были исследованиями второй и третьей фазы (на них уже оценивается эффективность лекарства), показали, что фавипиравир «демонстрирует благоприятный профиль безопасности»: доля серьёзных побочных эффектов составила A Review of the Safety of Favipiravir — A Potential Treatment in the COVID-19 Pandemic? 0,4 процента. Тем не менее проблемы с безопасностью препарата всё ещё остаются.
Японские исследователи, изучавшие перспективы применения препарата при тяжёлом гриппе, подчеркнули Favipiravir, an anti-influenza drug against life-threatening RNA virus infections , что Avigan противопоказан беременным женщинам: лекарство оказывало тератогенное и эмбриотоксическое действие на животных. Другие возможные проблемы Favipiravir (United States: Not commercially available; refer to Prescribing and Access Restrictions): Drug information : снижение аппетита, тошнота, рвота, увеличение концентрации мочевой кислоты в крови (гиперурикемия) и повреждение печени.
Сейчас читают 🔥
- Последствия коронавируса могут преследовать всю жизнь. Вот что известно об этом
Фавипиравир и COVID-19
В марте 2020 года Чжан Синьминь, директор Национального центра развития биотехнологий, который входит в состав китайского Минздрава, заявил Favipiravir shows good clinical efficacy in treating COVID-19: official , что фавипиравир «продемонстрировал хорошую клиническую эффективность против новой коронавирусной болезни (COVID-19)». Согласно данным Experimental Treatment with Favipiravir for COVID-19: An Open-Label Control Study как минимум одного открытого нерандомизированного исследования, 35 китайских пациентов с коронавирусный болезнью, получавших фавипиравир (в исследовании не сказано, о каком препарате шла речь — об оригинальном Avigan или о китайском лекарстве с таким же действующим веществом), выздоровели быстрее и меньше страдали от осложнений, чем 45 пациентов, которых лечили другими лекарствами (лопинавиром и ритонавиром).
В настоящее время действенность препарата против COVID-19 оценивают Coronavirus disease 2019 (COVID-19): Management in hospitalized adults в клинических испытаниях в Японии. 9 апреля FUJIFILM объявила Fujifilm Announces the Start of a Phase II Clinical Trial of its Influenza Antiviral Drug “Avigan® Tablet” for COVID-19 Patients in the U.S. о начале второго этапа клинических испытаний Avigan, который пройдёт в США, — в испытании примут участие 50 пациентов с коронавирусной болезнью. По некоторым зарубежным данным, в апреле-мае фавипиравир тестировали ещё в 16 клинических испытаниях, но ни одного завершённого клинического испытания, которое показало бы, что фавипиравир или Avigan эффективны против коронавирусной болезни, нет.
Российский препарат
Любое лекарство состоит из действующего вещества и наполнителя (готовой лекарственной формы). Российский противовирусный препарат содержит то же действующее вещество Первый российский препарат против коронавируса получил одобрение Минздрава , что и японский препарат, — то есть 200 миллиграмм фавипиравира на таблетку. Как в разговоре с «N + 1» указал представитель РФПИ Арсений Палагин, наполнитель у российского препарата свой. В инструкции сказано, что вспомогательные вещества включают микрокристаллическую целлюлозу, кроскармеллозу натрия, коллоидный диоксид кремния, стеарат магния и повидон К-30. Срок патентной защиты на оригинальный японский Avigan истёк в 2019 году, поэтому лекарство можно считать законно производимым дженериком.
Российские клинические испытания «Авифавира» также ещё не закончены. Завершены только первый и второй этапы многоцентрового рандомизированного исследования, подтверждает собеседник «N + 1» из РФПИ. В первом этапе приняли участие 60 человек — 20 из них вошли в контрольную группу, которая проходила лечение стандартными методами. Данные о возрастном составе и тяжести состояния испытуемых не раскрывались.
Вот что сообщают РФПИ и ГК «ХимРар» в июне поставят в российские больницы 60 тысяч курсов «Авифавира», первого зарегистрированного в РФ препарата против COVID-19 о результатах этих тестов сами разработчики:
- новых побочных эффектов в дополнение к тем, что много лет назад зафиксировали японцы, они не выявили;
- через четыре дня лечения у 65 процентов людей из экспериментальной группы тест на коронавирус дал отрицательный результат (в контрольной группе таких случаев было около 30 процентов);
- через три дня у 68 процентов людей из экспериментальной группы нормализовалась температура (у контрольной это произошло на шестой день).
Минздрав одобрил начало третьей фазы испытаний авифавира 1 мая 2020 года, в нём, согласно данным Государственный реестр лекарственных средств на сайте Государственного реестра лекарственных средств, должны будут суммарно принять участие 390 человек. Из тех же данных видно, что испытания фавипиравира проводят ещё две российские компании — «Технология лекарств» (входит в группу «Р-Фарм») и «Промомед». Обе компании начали испытания в конце мая.
Хотя испытания не завершены и известны только частичные данные об эффективности, Минздрав разрешил зарегистрировать препарат досрочно — по ускоренной процедуре, принятой в рамках постановления Постановление Правительства РФ от 3 апреля 2020 г. № 441 правительства РФ от 3 апреля 2020 года № 441. В этом постановлении говорится, что «сокращение объёма <…> экспертиз» допустимо «в условиях угрозы возникновения и ликвидации чрезвычайной ситуации».
Так что компания-производитель уже обещает РФПИ и ГК «Химрар» в июне поставят в российские больницы 60 тыс. курсов «Авифавира», первого зарегистрированного в РФ препарата против COVID-19 к концу следующей недели привезти первые партии таблеток в больницы.
В инструкции Инструкция по медицинскому применению лекарственного препарата «Авифавир» к препарату написано, что она «подготовлена на основании ограниченного объёма клинических данных по применению препарата и будет дополняться по мере поступления новых данных». Тем не менее уже определены противопоказания. Как и в случае с японским Avigan, это планирование беременности, беременность и период грудного вскармливания — дженерик тоже потенциально тератогенный. Пациентам с подагрой и гиперурикемией применять лекарство нужно с осторожностью. Кроме того, список противопоказаний к российскому дженерику дополнили повышенная чувствительность к действующему веществу, возраст до 18 лет, тяжелая печеночная и почечная недостаточность.
В аптеки лекарство поступать не будет: согласно инструкции, использовать препарат можно только в условиях стационаров.
Что в итоге
«Авифавир» — дженерик лекарственного препарата фавипиравира, у которого есть внятный механизм действия и который проходит клинические испытания в России и за рубежом.
Результаты промежуточных клинических испытаний показывают, что лекарство перспективное: на тех небольших выборках, что его успели проверить, лечебный эффект, судя по заявлениям разработчиков, определить удалось. Но до тех пор, пока клинические испытания не завершатся и их результаты не будут опубликованы в рецензируемых международных журналах, мы не можем быть полностью уверены, что «Авифавир» действительно помогает от коронавирусной болезни. Пресс-служба «ХимРара», разработчика лекарства, на момент публикации этого текста на вопросы N+1 не ответила.
Сейчас у нас нет лекарств, которое целенаправленно и эффективно действовало именно против вируса SARS-CoV-2. Все претенденты на этот титул сейчас — вещества, известные до появление нового коронавируса, которые в клинических испытаниях (начавшихся буквально только что) стабильно показывают какой-то положительный эффект с рядом ограничений. Их прямо сейчас — два.
Первый — это ремдесивир, не сходивший с первых полос в мае — лекарство, которое ещё до эпидемии COVID-19 предназначалось для лечения другой коронавирусной инфекции, ближневосточного респираторного синдрома (MERS). Американский регулятор одобрил клиническое применение ремдесивира, не дожидаясь формального окончания испытаний лекарства — наличие стабильного эффекта в предварительных данных исследований убедило медицинских чиновников. Эту ситуацию сравнивали All Eyes on Gilead с досрочной регистрацией AZT Зидовудин , первого лекарства от ВИЧ.
При этом ремдесивир никогда не претендовал на статус «серебряной пули»: испытания показывают Remdesivir for the Treatment of Covid-19 — Preliminary Report , что людям с тяжёлыми симптомами — которым нужна искусственная вентиляция легких — он помочь не может, а тем, у кого симптоматика легче, сокращает время болезни на четыре дня. Многие другие эффекты — например, снижение летальности болезни по сравнению с другими лекарствами — со статистической значимостью в ходе этих испытаний показать не удалось. Выборка испытаний ремдесивира, отчёт о которых опубликовал в конца мая журнал New England Journal of Medicine, составила 1059 человек.
60 испытуемых — это много или мало?
Число испытуемых, необходимых для проверки эффективности препарата, рассчитывается по специальным формулам, в которых учитывается множество переменных: например, особенности показателей, которые предполагается учитывать, их разброс, уровень отклонения от показателей контрольной группы, который будет считаться клинически значимым.
Назначаются показатели, которые будут учитываться во время испытаний. Главный из них — как правило, смертность. В случае респираторных инфекций используются интегральные показатели, в которых учитывается, например, число дней с лихорадкой, время в реанимации или отделении интенсивной терапии, на ИВЛ, кашель. Все они по определ§нной формуле преобразуются в баллы, а затем баллы экспериментальной группы сравниваются с баллами контрольной группы.
Для каких-то исследований достаточно будет 20 испытуемых. Для каких-то не хватит и 2 тысяч.
Перед началом клинических исследований могут проводиться пилотные испытания на небольшой группе. Не редкость ситуации, когда эффект, обнаруженный на группе в несколько десятков человек, впоследствии «размывается» в больших группах.
Фавипиравир, как и ремдесивир, изначально не разрабатывался как средство именно против нового коронавируса. Препарат много лет назад — настолько, что патент на него уже истёк — приспособили под лечение гриппа (строго новых вирусов, а не сезонных болезней) и испытывали против вирусов Эболы и Зика.
Да, российским исследователям, кажется, удалось поймать эффект его применения при лечении COVID-19 — но пока на небольшой выборке в 60 человек, подробной информации о методах подбора и составе которой нет.
Так что таблетки у нас, кажется, есть. А чтобы удостовериться в том, что это действительно лекарство, придётся подождать ещё немного.













